História Modelos Atômicos
MODELOS
ATÔMICOS
Desvendar os segredos da matéria, sua estrutura, sua constituição, sempre foi um desejo dos estudiosos.
Cinco séculos antes de Cristo, os filósofos gregos especulavam a respeito da
matéria: seria ela contínua ou descontínua?
Demócrito e Leucipo eram partidários da descontinuidade,
isto é, a matéria poderia ser dividida em partes cada vez
menores, até um limite. A esse limite deram o nome de ÁTOMO, que em grego significa
"indivisível".
MODELO ATÔMICO DE DALTON
O modelo de Dalton foi elaborado em
1808 e é conhecido como “modelo da bola de bilhar” por representar os
átomos como pequenas bolas redondas, maciças e indivisíveis. Para ele, átomos
de um mesmo elemento são
idênticos e elementos diferentes apresentam átomos diferentes. Em uma reação
química ocorre a reorganização dos átomos, os quais se unem em varias
proporções e mantendo suas massas.

MODELO DE
THOMSON
Apesar do modelo de Dalton ter sido o ponto de partida
para compreender a estrutura da matéria, ele não explicava uma série de
fenômenos.
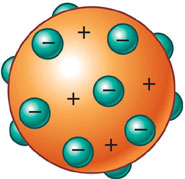
Thomson
então propôs que o átomo seria constituído por uma esfera com carga positiva e
os elétrons estariam incrustados nessa
esfera, de tal forma que o total de cargas positivas fosse igual ao
total de cargas negativas. Tal modelo ficou conhecido como "modelo do
pudim de passas".
MODELO DE
RUTHERFORD
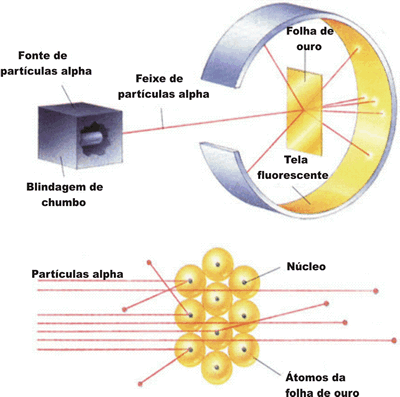
Em 1911, Rutherford bombardeou uma fina lamina de ouro
com partículas alfa. O resultado da experiência, revelou que 99% das partículas
atravessaram a lamina sem desvio, algumas desviaram e atravessaram e outras
desviaram e retornaram. Para explicar os resultados experimentais, Rutherford
propôs um modelo nuclear, isto e, haveria no átomo um núcleo muito pequeno e
positivo e os elétrons girariam ao redor do núcleo. Essa região ao redor do
núcleo, onde se encontram os elétrons, é chamado de eletrosfera. O
elétron é muito leve, cerca de 1836 vezes mais leve que o próton. Esse modelo é
conhecido como “modelo planetário”.
 Em
1920, Rutherford propôs que no núcleo, além dos prótons, deveria existir pares de prótons e
elétrons, os quais ele chamou de nêutrons. Somente em 1932, Chadwick
descobriu a existência dos nêutrons.
A maior parte da massa do átomo se encontra
no núcleo, onde se encontram os prótons e os nêutrons.
Em
1920, Rutherford propôs que no núcleo, além dos prótons, deveria existir pares de prótons e
elétrons, os quais ele chamou de nêutrons. Somente em 1932, Chadwick
descobriu a existência dos nêutrons.
A maior parte da massa do átomo se encontra
no núcleo, onde se encontram os prótons e os nêutrons.

MODELO DE BOHR
O modelo de Rutherford afirmava que os elétrons giravam
em torno do núcleo, a uma certa distância. No entanto, sabia-se na época, que
elétrons girando em torno do núcleo deveriam perder energia e assim, sua órbita
seria cada vez mais próxima do núcleo, o que acabaria provocando sua queda no
núcleo, o que seria uma volta ao modelo de Thomson. Era um dilema: se o elétron
girasse em torno do núcleo, deveria perder
energia e ficar grudado no núcleo, mas como explicar os resultados obtidos
por Rutherford?
Em 1913, Niels Bohr propôs que as leis da Física, vigentes na época, não se aplicavam ao
elétron, pois sua massa era muito pequena. Propôs que o elétron giraria em
torno do núcleo em órbita circular, sem absorver ou emitir energia (sendo
assim, o elétron não se precipitaria para o
núcleo). Fornecendo-se energia ao elétron, ele salta de uma órbita para outra
mais externa. Da mesma forma, quando um elétron "excitado"
retornar a
sua órbita, ele emitiria
a energia absorvida.
Surgia assim
o modelo dos níveis de energia, isto é, os elétrons de um
átomo não estariam todos na mesma órbita e sim distribuídos em órbitas
(K, L, M, N, 0 e P).


O modelo das
órbitas circulares foi alterado por Sommerfeld
que propôs que as órbitas seriam elípticas, tal como no sistema planetário
e imaginou que algumas das órbitas, camadas ou níveis do átomo de
Rutherford-Bohr seriam formadas por subcamadas ou subníveis, e que um subnível
seria circular e os demais teriam a forma de elipses.

Nenhum comentário:
Postar um comentário